什么是CHO细胞?
CHO细胞:生物制药的“黄金标准”
CHO细胞(Chinese Hamster Ovary cells,中国仓鼠卵巢细胞)是全球生物制药的核心工具,生产了70%以上的重组蛋白药物,包括单抗、疫苗、凝血因子等。其应用覆盖癌症、自身免疫疾病、传染病治疗等领域,是当今生物医药工业的基石。
一、起源与生物学特性
1957年由美国科学家George Puck从中国仓鼠卵巢组织分离建立,最初用于染色体研究。
1987年首个CHO细胞生产的重组药物(组织纤溶酶原激活剂)获批上市,开启工业化时代。
核心特性
形态:上皮样或成纤维细胞样,贴壁或悬浮生长。
遗传缺陷:缺乏L-脯氨酸合成能力,需外源补充,便于筛选稳定转染株。
安全性:不携带人类病毒(如HIV、乙肝病毒),降低药物污染风险。
______
二、为何成为“生物制药黄金标准”?
高效蛋白表达
产量高:通过CRISPR基因编辑,单抗产量可达>1g/L。
人源化修饰:糖基化结构与人类相似度>95%,显著降低药物免疫原性。
工业化适配性
悬浮培养:密度达20–30×10⁶ cells/mL,适配百升至万升生物反应器。
无血清培养基:化学成分明确(如ProGro™、CDM4CHO),减少批次差异。
严格质控
STR鉴定:确保细胞株身份唯一性,避免交叉污染。
______
三、核心应用场景
✅ 1. 重组蛋白药物
单克隆抗体:
阿达木单抗(年销>200亿美元)、帕博利珠单抗(年销>250亿美元)。
酶与激素:促红细胞生成素(EPO)、凝血因子。
✅ 2. 疫苗开发
HPV疫苗:表达病毒L1蛋白自组装成病毒样颗粒(VLP)。
新冠疫苗:重组亚单位疫苗表达S蛋白RBD片段(2022年马里临床试验)。
✅ 3. 基因工程改造
CRISPR技术:敲除降解蛋白酶基因提升产物稳定性。
表观调控:抑制miR-23a可使抗体产量提升42%。
______
四、培养技术要点
⚠️ 1. 关键参数
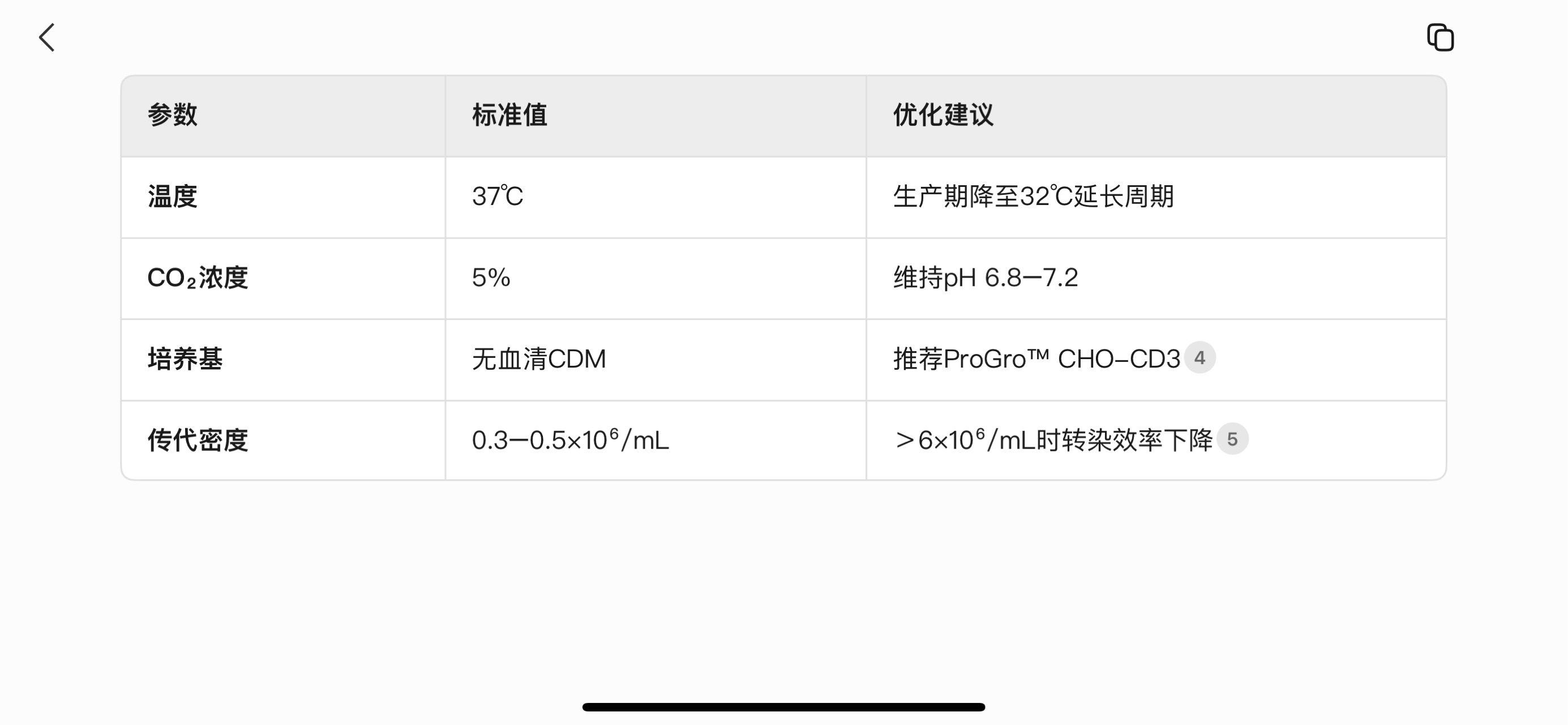
⚠️ 2. 常见问题解决
细胞凋亡:添加保护剂(如Kolliphor HS 188)。
表达量低:转染24小时后补加3%营养补料。
糖基化变异:选用工程化亚株(如CHO-S)。
______
五、CHO细胞亚系对比
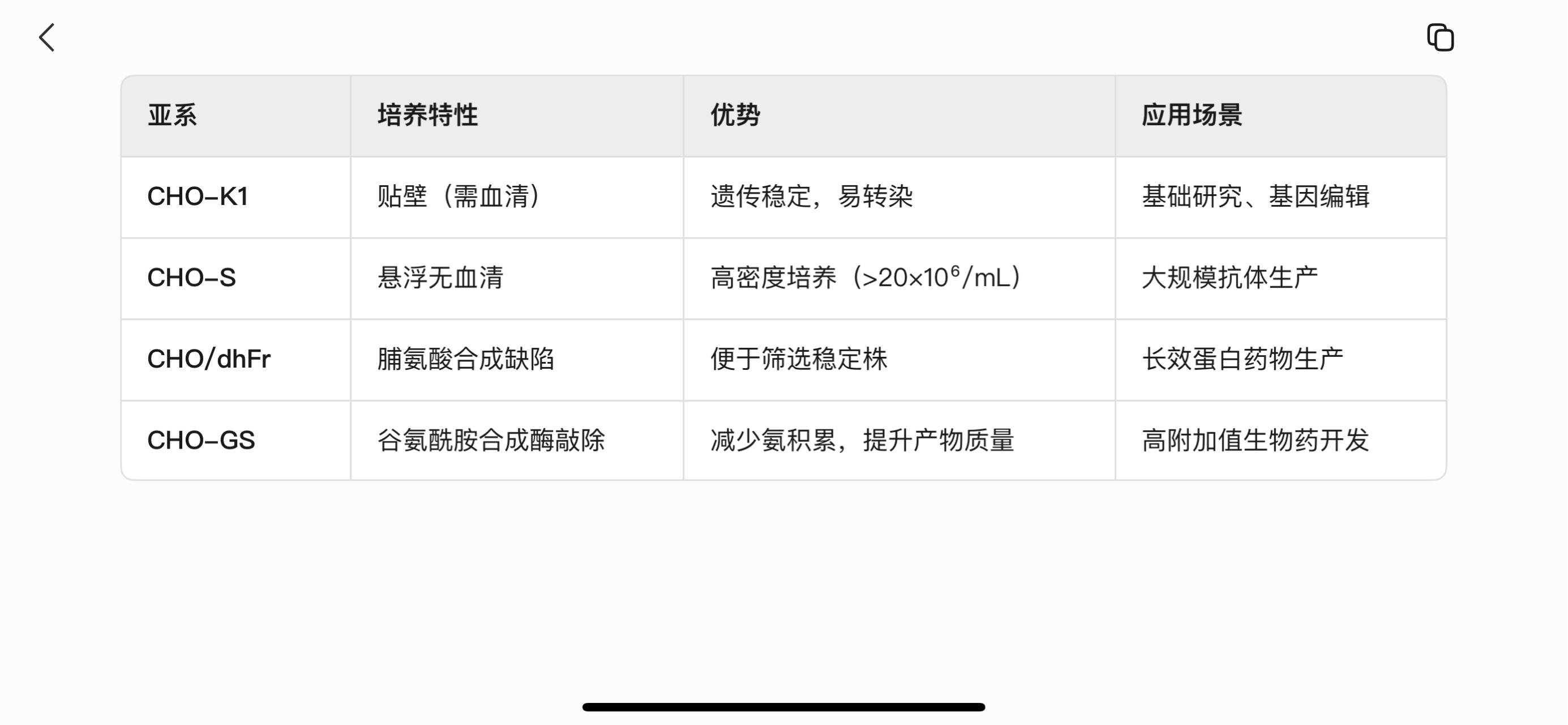
六、未来展望
随着灌流工艺优化(培养周期延长至120天)和基因编辑技术突破,CHO细胞将在基因治疗、新型疫苗开发中持续释放价值。
一句话总结:CHO细胞——人类对抗疾病的“超级细胞工厂”,用生物合成的精密性,重塑医药未来。
______
参考资料:
CHO细胞培养基与培养工艺(洁特生物)
CHO细胞在生物制药中的应用(生物医药前沿)
重组新冠疫苗CHO细胞临床试验(沃森生物)
