长糖链皂苷的生物合成研究进展-文献精读149
Advances in the biosynthesis of long sugar-chain saponins
长糖链皂苷的生物合成研究进展

摘要
含有多个糖基的长糖链皂苷是常见的植物次生代谢产物,具有调节免疫、抗肿瘤、降脂等药理活性,糖链组成差异是其结构多样性的重要原因。近期,英国约翰英纳斯中心Anne Osbourn教授团队和美国佐治亚大学Jim Leebens-Mack教授团队在Nat. Chem. Biol.期刊上发表了一篇文章,解析了肥皂草中八糖皂苷Saponarioside B的生物合成途径。其他长糖链皂苷如avenacin A-1、yossoside V、α-tomatine、QS-21等的生物合成途径也已于近年阐明。本文将结合相关研究,针对长糖链皂苷生物合成途径中的糖基化酶进行评论,为长糖链皂苷的生物合成酶挖掘与生物制造提供思路,为植物源皂苷的合成生物学提供线索。
皂苷是糖苷的一种,因具有类似于肥皂的表面活性而得名,由苷元和糖两部分组成。皂苷的苷元通常为三萜或甾体,常见的糖包括葡萄糖、半乳糖、木糖、阿拉伯糖、鼠李糖、葡萄糖醛酸等。糖基可以直接与苷元相连,也可与其他糖相连,形成糖链。糖链延长后,表现出更强的佐剂活性、抗肿瘤活性等[1, 2],因此受到国内外学者的广泛关注。含有较长糖链的皂苷结构复杂多样、化学合成困难,采用生物合成方法对其进行制备,具有较好的应用前景。但是,该类化合物的生物制造还存在很多挑战,特别是糖链的生物合成途径解析存在困难。本文主要针对含有较长糖链的皂苷,对其生物合成研究开展评述。为便于叙述,将该类化合物简称为“长糖链皂苷”,指皂苷分子中至少一个糖链含有的糖基数目在三个或以上。
近期,英国约翰英纳斯中心Anne Osbourn教授团队和美国佐治亚大学Jim Leebens-Mack教授团队在Nat. Chem. Biol.期刊上发表了一篇文章:Unlocking saponin biosynthesis in soapwort[3]。在该研究中,作者完成了对肥皂草(Saponaria officinalis)的基因组测序,并通过基因挖掘和烟草瞬时表达,鉴定了八糖皂苷Saponarioside B生物合成中涉及的14个关键酶,打通了其生物合成途径。长糖链皂苷已作为疫苗佐剂在临床使用,如QS-21、Matrix-M等,具有B细胞激活、增强免疫细胞抗原呈递等药理活性。长的糖链可以增强分子亲水性,也可以形成胶束包裹抗原,延长抗原在体内的滞留时间,促进淋巴器官摄取等[2, 4]。鉴于长糖链皂苷的潜在药用价值,实现其生物制造对药物研发具有重要意义。本文对该项研究成果进行介绍,并结合近期其他长糖链皂苷(avenacin A-1, yossoside V, α-tomatine, QS-21, 图1)的生物合成研究开展评述,为植物糖基化酶的发现和合成生物学应用提供参考。
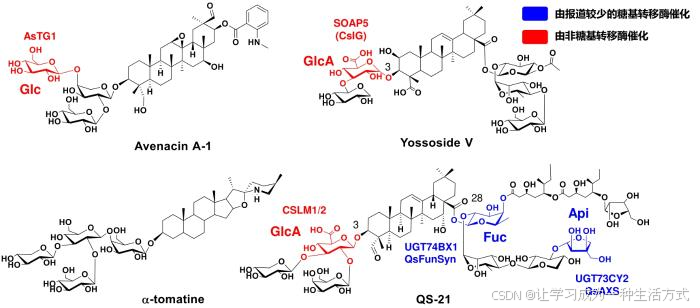
图1 知名长糖链皂苷的结构式
作者以肥皂草中的主要皂苷Saponarioside B(SpB,八糖皂苷)与Saponarioside A(SpA,九糖皂苷,SpB的木糖基化产物)作为研究对象。首先,测定了肥皂草的主要组织(根、茎、老叶、嫩叶、花、花蕾)中SpB与SpA的含量,发现SpA主要富集在肥皂草花和花蕾中,SpB主要富集于嫩叶和老叶中。同时,进行了基因组测序和转录组测序,获得了肥皂草染色体水平的高质量基因组。之后,作者在基因组中挖掘到预测为β-香树脂醇(β-amyrin)合成酶的Saoffv11003490m和Saoffv11027757m两条基因,并利用农杆菌介导的烟草瞬时表达,经质谱检测与标准品比对证明后者编码的蛋白可以发挥β-香树脂醇合成酶的功能,并将该基因命名为SobAS1。
作者接下来通过SobAS1基因在花中高表达及SpA在花中高含量的特征,根据目前已知的三萜类生物合成的酶类型,通过共表达和功能注释,从14000个基因中筛选了在花中高度共表达的26个基因(Pearson相关系数PCC>0.885)。首先,经过烟草瞬时表达活性验证鉴定了3个细胞色素P450酶的功能。CYP716A378和CYP716A379分别将β-香树脂醇羧基化和羟基化生成齐墩果酸和次囊酸,接着在另一个细胞色素P450酶CYP72A984的作用下氧化生成苷元皂皮酸(QA)。针对糖链合成,作者对肥皂草皂苷进行代谢物分析,发现C-3位糖基化中间体均在早期步骤中积累,而C-28位糖基化中间体则较晚出现,由此认为在肥皂草皂苷的生物合成中,C-3位首先被糖基化。根据纤维素合酶类似酶(cellulose synthase-like enzyme,CSL)催化三萜皂苷元3-O-葡萄糖醛酸化的报道[5, 6, 9],发现与SobAS1高度共表达的SoCSL1基因,并验证其编码的蛋白功能为QA的C-3-O-葡萄糖醛酸化。接着对高度共表达的UDP-糖基转移酶(UDP-glucuronosyltransferase,UGT)在烟草底盘中进行功能鉴定,UGT73DL1和UGT73CC6对3位糖链进行延伸,依次催化半乳糖基化反应和木糖基化反应;UGT74CD1催化C-28位的岩藻糖基化,但产物含量很低。参考QS-21的生物合成途径[6],岩藻糖糖基化并非以UDP-岩藻糖作为糖供体,而是以UDP-4-酮-6-脱氧葡萄糖(UDP-鼠李糖生物合成中的中间体)作为糖供体,完成糖基化反应后,在短链脱氢酶(SDR)作用下原位还原为岩藻糖基(图3)。按照这一思路,作者在与SobAS1高共表达的候选基因中找到了一个SDR候选基因SoSDR1,证明肥皂草也是通过类似的途径完成岩藻糖基化反应。接着,UGT79T1、UGT79L3和UGT73M2在母核C-28位岩藻糖的C4-OH上进行糖链延伸,依次加上鼠李糖和两个木糖。SpB糖链上的最后一个糖是喹诺糖,通常存在于海洋动物代谢物中,在植物中较为罕见。高度共表达的UGT候选基因均未显示出喹诺糖基转移酶活性。然而,一个预测编码GH1家族转糖酶(transglucosidase,TG)的基因SoGH1与SobAS1高度共表达,通过烟草表达证实SoGH1催化喹诺糖连接到岩藻糖C4-OH。最后,同样通过共表达筛选出酰基化酶SoBAHD1催化喹诺糖乙酰化得到终产物SpB(图2)。
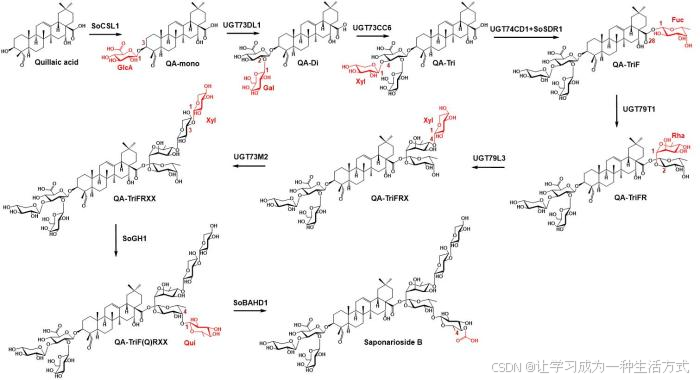
图2 Saponarioside B的糖链生物合成途径
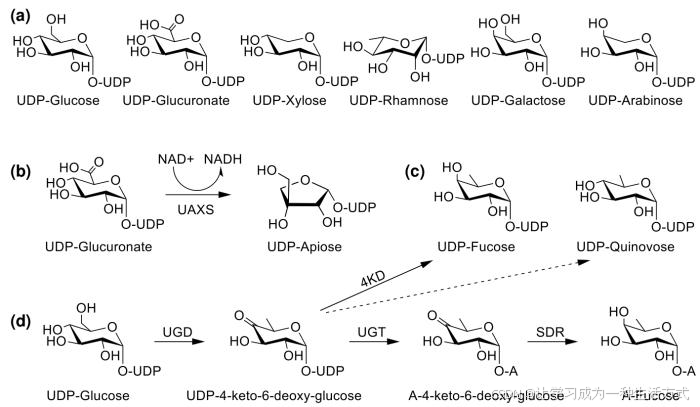
图3 皂苷生物合成的UDP糖供体及部分糖供体的合成过程
(a,糖基转移酶研究较多的UDP-糖供体;b,UDP-芹糖的生物合成途径;c,UDP-岩藻糖及UDP-喹诺糖的结构式;d,QS-21合成过程中的岩藻糖基化反应及UDP-岩藻糖生物合成途径。A, 苷元;UAXS,UDP-芹糖/木糖合酶;UGD,UDP-葡萄糖-4,6-脱氢酶;4KD, 4-酮基还原酶;SDR, 短链脱氢酶/还原酶)
值得注意的是,作者发现的转糖酶SoGH1与常见的糖基转移酶不同,它利用多种酰基糖作为糖供体,如苯甲酰、羟基肉桂酰等,并可利用黄酮糖苷为供体。大多数已报道的转糖酶催化葡萄糖基化,仅一例催化半乳糖基化,催化喹诺糖基化的酶是首次报道。同时,SoGH1不在液泡而在胞质中定位,这与大多数GH1转糖酶定位于液泡的性质不同。最后,作者发现SpB与QS-21的生物合成途径展现出高度的相似性:尽管这两种皂苷来源于亲缘关系较远的物种,但它们在合成过程中拥有相同的中间体(如QA-TriFRXX),此后才发生分化。这一发现暗示了两种植物可能独立演化出相似的次生代谢途径。
长链皂苷的糖链结构与其生物活性密切相关。QS-21及其衍生物的构效关系研究表明[10],QS-21的长糖链与独特的酰基化芹糖是其高效免疫活性的关键基团,对于糖链较短的皂苷,其水溶性降低,与免疫细胞表面受体相互作用减弱,可能导致佐剂活性下降。QS-21末端的酰基化芹糖可以增强Th1反应,而木糖则偏向Th2应答。此外,糖上的酰基化也影响疫苗佐剂活性。因此,解析长糖链皂苷的生物合成途径,提升其可及性与结构多样性,对候选药物及疫苗佐剂开发具有重要意义。
近年来,皂苷糖链合成研究中不断发现新的糖基化酶、新的糖供体,且其催化机制及胞内定位呈现显著的多样性,这给研究带来很大挑战。在八糖皂苷SpB的糖链合成途径中,涉及了三种不同类型的糖基化酶:UDP-糖基转移酶、纤维素合酶类似酶、转糖酶。发现新颖的喹诺糖转糖酶SoGH1,并发现了较为稀有的纤维素合酶类似酶SoCSL1、岩藻糖糖基转移酶UGT74CD1。回顾此前报道的植物长糖链皂苷糖基化途径,这些新颖催化反应往往有迹可循。例如,燕麦Avenacin A-1生物合成中的葡萄糖基化反应由GH1家族转糖酶AsTG1催化,在骨架C3位阿拉伯糖的C4-OH链接葡萄糖[7]。菠菜Yossoside V生物合成的3-O-葡萄糖醛酸化步骤由GT2家族的纤维素合酶类似酶CslG催化[5],皂树皂苷QS-21生物合成的岩藻糖基化步骤由UGT74BX1利用UDP-4-酮-6-脱氧葡萄糖为供体催化连接至母核的C-28位,再经QsFucSyn还原为岩藻糖基[6]。这些研究表明植物长糖链皂苷的合成机制虽然多样,但不同植物间仍存在一定的共性。
UDP-糖基转移酶(UGT)是长糖链皂苷生物合成中最常见的糖基化酶。将上文提到的部分UGT与已知功能的UGT作进化分析(图4),可见部分皂苷UGT可以与酚类UGT区分,而少部分仍与酚类UGT混杂。同时,长糖链皂苷糖基转移酶并不完全按照来源物种、底物结构、加糖位点等聚类,规律性较弱。转糖酶及纤维素合酶类似酶因其有功能的序列较少,本文未作进化树分析,但文献也报道燕麦AsTG1与肥皂草SoGH1序列相似度较低。此外,以燕麦Avenacin A-1[7]、番茄α-tomatine[10]和皂树QS-21[6]为代表的生物合成研究发现,三萜皂苷生物合成的修饰基因(如CYP450、UGT、CSL等)倾向于在染色体上成簇分布,这种基因组共定位现象通过确保代谢通路相关酶的协调表达、减少转录调控的随机噪声、增强遗传稳定性等手段显著提升了次级代谢产物的合成效率。燕麦Avenacin A-1的生物合成基因形成了高度紧凑的基因簇;番茄α-tomatine和皂树QS-21的生物合成基因不全在基因簇中,提示不成簇的基因的功能可能在其他代谢通路中共享;但SpB、Yossoside V等皂苷暂无生物合成基因成簇报道。结合长糖链皂苷生物合成途径的特征,在解析其糖链合成时往往需要结合多种基因挖掘方法。基于序列相似度的筛选往往并非最有效的方式,而共表达分析、基因簇分析、及已有文献报道往往能提供更好的参考。
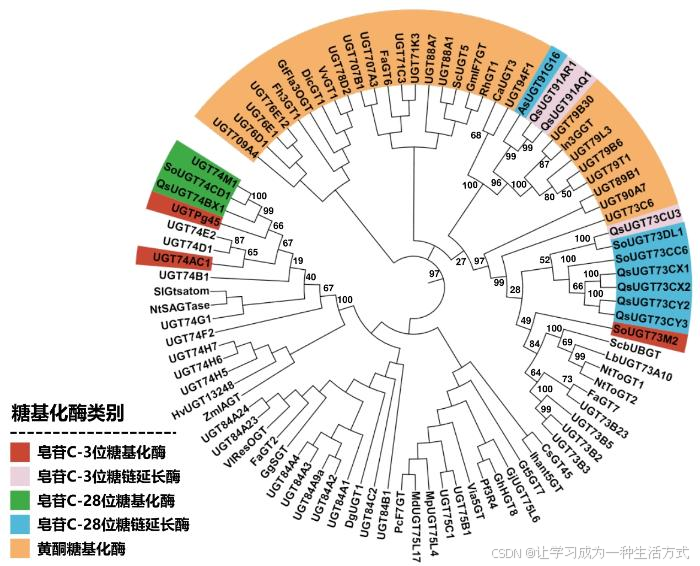
图4 糖苷类化合物糖基转移酶的序列相似度分析
(UGT74H5, XRL31186.1; UGT74H6, ACD03261.1; UGT74H7, ACD03246.1; UGT91G16, QHG10987.1; UGT71C3, CAE7210926.1; UGT73B2, OAO97622.1; UGT73B3, OAO99384.1; UGT73B5, OAP10701.1; UGT73C6, OAP07438.1; UGT74B1, OAP18511.1; UGT74D1, OAP11252.1; UGT74E2, OAP17332.1; UGT74F2, OAP07463.1; UGT75B1, OAP16927.1; UGT75C1, Q0WW21.2; UGT76D1, OAP10891.1; UGT76E1, OAO90200.1; UGT76E12, OAP06710.1; UGT78D2, OAO89857.1; UGT79B6, NP_200212.1; UGT84A1, OAO99238.1; UGT84A2, OAP06181.1; UGT84A3, OAP00592.1; UGT84A4, OAO98847.1; UGT84B1, OAP11221.1; UGT88A1, OAP04631.1; UGT89B1, OAP14423.1; UGT84A9a, CAS03354.1; CaUGT3, BAH80312.1; UGT707B1, CCG85331.1; CsGT45, ACM66950.1; DgUGT1, BAO66179.1; DicGT1, BAD52003.1; FaGT2, Q66PF4.1; FaGT6, Q2V6K0.1; FaGT7, Q2V6J9.1; UGT71K3, P0DO49.1; UGT73B23, XP_004304022.1; Fh3GT1, ADK75021.1; GgSGT, BAG14302.1; GhHGT8, Q9ZR25.1; GjUGT75L6, F8WKW0.1; GmIF7GT, NP_001235161.1; UGT79B30, BAR88077.1; Gt5GT7, B2NID7.1; GtFla3OGT, Q96493.1; UGT74M1, ABK76266.1; HvUGT13248, ADC92550.1; Ihant5GT, BAD06874.1; In3GGT, Q53UH4.1; LbUGT73A10, BAG80536.1; UGT75L17, AAX16493.1; UGT75L4, ABL85474.1; NtSAGTase, AAF61647.1; NtToGT1, Q9AT54.1; NtToGT2, AAB36652.1; UGT707A3, BAC83989.1; UGT709A4, BAC80066.1; PcF7GT, AAY27090.1; Pf3R4, BAA36421.1; UGT88A7, BAG31949.1; UGTPg45, AKA44586.1; UGT90A7, ACB56926.1; UGT84A23, ANN02875.1; UGT84A24, ANN02877.1; QsUGT74BX1, WEU75090.1; QsUGT73CY2, WEU75102.1; QsUGT73CY3, WEU75103.1; QsUGT73CX1, WEU75094.1; QsUGT73CX2, WEU75095.1; QsUGT73CU3, WEU75099.1; QsUGT91AR1, WEU75091.1; QsUGT91AQ1, WEU75104.1; RhGT1, BAD99560.1; SoUGT74CD1, WWM48152.1; SoUGT73M2, WWM48153.1; SoUGT73CC6, WWM48156.1; SoUGT73DL1, WWM48158.1; SoUGT79T1, WWM48161.1; SoUGT79L3, WWM48150.1; ScbUBGT, BAA83484.1; ScUGT5, BAJ11653.1; UGT74AC1, AEM42999.1; SlGtsatom, CAI62049.1; UGT74G1, Q6VAA6.1; Via5GT, AHL68667.1; VlResOGT, ABH03018.1; UGT94F1, BAI44133.1; VvGT1, AAB81683.1; ZmIAGT, AAA59054.1)
糖链合成途径的解析为长糖链皂苷的合成生物学制造提供了有效的催化元件,使其生物制造成为可能。目前,本文提到的长糖链皂苷中仅有QS-21实现了异源从头合成。Keasling团队在酵母中引入38个异源基因,重建了QS-21的生物合成途径,目前产量可达0.0012%酵母干重,是有史以来构建的最长的生物合成途径之一[10]。其中,糖基化酶细胞定位不同、适配性差是其重要限速步骤,对多种糖供体的需求也影响了合成效率。虽然产率有限,仍为减少植物资源损耗做出了关键的探索。五糖皂苷罗汉果苷V(mogroside V)也于今年实现了酵母底盘全合成,产量为28.62 mg/L[11]。此外,蛋白相互作用也会影响长糖链皂苷的合成产率,例如,茄科植物中的糖基化酶GAME15(纤维素合酶类似酶M家族)可作为支架蛋白与上游的甾体氧化酶(GAME6、GAME8、GAME11)形成酶复合物,提升茄科植物中甾体生物碱皂苷的产率[12]。这也提示研究者在异源合成时可引入类似的蛋白相互作用,减少中间产物的扩散损耗。
虽然长糖链皂苷的研究取得了飞速进展,仍有多个具有潜在药用价值的皂苷类化合物,其生物合成途径尚未解析。例如洋地黄毒苷含有罕见的洋地黄毒糖(2,6-二脱氧糖),目前尚无相关活性的糖基转移酶报道;远志皂苷F是含有阿拉伯糖、木糖、鼠李糖、芹糖、岩藻糖、葡萄糖6个糖基的双糖链酯皂苷;合欢皂苷J1含有鸡纳糖、鼠李糖等9个糖基并连有2个单萜酸。这些长糖链皂苷的糖基化酶值得深入挖掘。除了上文提到的基因挖掘方法外,大数据和人工智能也将服务于长糖链皂苷生物合成的基因发现、酶功能改造、代谢通路设计等。总之,天然产物化学已充分揭示了长糖链皂苷结构的多样性,如何在体外重塑和扩展这些结构多样性,为药物研发提供候选分子,将是合成生物学的重要任务。
