《基于蛋白质组学的精准医学》:研究进展与未来展望
精准医学的发展历程,体现了医学研究从宏观到微观、从群体到个体的转变。早期疾病分类主要依赖临床症状和病理表现,世界卫生组织(WHO)制定的国际疾病分类(ICD)标准为疾病诊断和管理奠定了基础,但这类传统分类往往忽视了个体差异。进入21世纪后,基因组学的兴起推动精准医学实现第一次飞跃,研究者开始关注个体基因差异对疾病的影响。然而,随着研究深入,仅靠基因组信息的局限性逐渐显现:许多疾病的遗传贡献低于预期,部分癌症的遗传易感性不高,仅通过基因检测开展的靶向治疗能覆盖的患者比例有限。这一现实促使医学界将目光投向基因的下游产物——蛋白质。因为蛋白质是生命活动的直接执行者,环境因素和基因表达调控的最终结果,都会体现在蛋白质水平上。
蛋白质组学在精准医学中的重要性日益突出。蛋白质组学是从整体水平研究蛋白质表达与功能的学科,能够揭示基因表达产物在不同时间、空间的动态变化。基因的转录和翻译过程受多种因素调控,mRNA水平与蛋白质水平并非始终一致,且蛋白质还会经历翻译后修饰等复杂过程。因此,蛋白质组学可提供比基因组学更直接的疾病状态信息。通过大规模分析蛋白质的表达谱、翻译后修饰及相互作用网络,蛋白质组学有望填补基因组学留下的信息空白,助力我们更全面地理解疾病机制。
2025年7月,国家蛋白质科学中心的贺福初院士团队在National Science Review发表了题为The coming era of proteomics-driven precision medicine的论文。该文章明确了蛋白质组学在精准医学中的核心价值,梳理了其技术与应用进展,并构建了发展框架——针对基因组驱动精准医学的局限,论证了蛋白质组学作为 “基因功能直接执行者” 的优势,整合了核心技术成果,为未来研究和临床实践指明了方向。

蛋白质组学医学的关键技术总述:
以诺贝尔生理学或医学奖得主悉尼・布伦纳提出的 “CAP 标准”(全面性、准确性和永久性)为黄金标准,蛋白质组学研究需深入解析蛋白质序列、功能及精确时空定量,且成果需长期有效。临床中虽面临样本类型多样、检测灵敏度要求高、需高通量分析和大数据处理等挑战,但该领域仍取得了显著进展。
- 蛋白质表达谱:过去三十年,样本制备(如压力循环技术、单管固相增强样品制备)、肽分离(如多维分离技术)、质谱测序等技术及大数据、深度学习的应用,推动了蛋白质鉴定与定量的进步。自下而上和自上而下的质谱方法适用于不同场景,iTRAQ、TMT、无标记定量和数据非依赖采集等技术提升了通量、稳定性和重现性,可从单个 HeLa 细胞高通量定量约 5000 种蛋白质,助力构建多物种蛋白质组参考图谱。
- 翻译后修饰谱:蛋白质的磷酸化、乙酰化、泛素化、糖基化、乳酸化等翻译后修饰,通过 “写入器”“擦除器”“读取器” 构成的修饰密码调控功能。磷酸化研究推动癌症激酶抑制剂开发,72种已获FDA批准;乙酰化等修饰的研究也为疾病机制和治疗提供见解,且超650种修饰被发现,技术进步将不断拓展修饰清单,助力精准医学和药物研发。
- 蛋白质-蛋白质相互作用网络:蛋白质互作形成复合物和网络,在分子到生物体多层面产生涌现特性,其异常会导致疾病。酵母双杂交等技术可系统研究互作,相关网络分析为理解疾病机制、发现药物靶点(如致癌性互作)、药物重定位及生物标志物筛选提供支持,还能结合患者数据构建个性化互作组,助力精准治疗。
- 空间蛋白质组:蛋白质位置与其功能密切相关,空间蛋白质组学通过高分辨率技术(如 DISCO-MS、激光捕获显微切割)揭示蛋白质空间分布与功能的关联。可发现疾病生物标志物(如动脉粥样硬化的MYH10和MYH11),解析肿瘤等疾病的分子异质性,单细胞水平的深度视觉蛋白质组学等技术还能识别治疗靶点,推动 “实践智慧医学” 等新临床决策范式。
- 蛋白质组学资源:PRIDE、iProX等数据库存储海量数据,经pFind、MaxQuant等工具转化为信息,再通过dbPTM、BioGRID等资源深化为生物学和疾病机制知识,最终指导临床实践,形成“数据-信息-知识-智慧”体系,支撑个性化医疗发展。
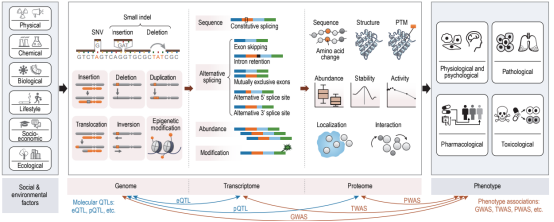
蛋白质组在表型中的关键作用
人类蛋白质组参考图谱突破:
人类蛋白质组计划(HPP)通过质谱技术成功验证93%(18,138/19,411)的人类蛋白编码基因,揭示蛋白质的多样性通过蛋白质形态(proteoforms)实现—即由遗传多态性、RNA剪接变异和翻译后修饰(PTMs)组合形成的功能变体。空间蛋白质组学研究绘制了多器官(心脏、脑、皮肤、肝脏)的分子图谱:肝脏中实质细胞与非实质细胞的分工协作维持代谢通路平衡;脑突触蛋白质组鉴定出1,800种突触特异性蛋白,建立18种突触类型的模块化模型;全身21种组织与8种血细胞的蛋白质分布图谱首次实现血浆蛋白的精准组织溯源。这些成果为理解器官功能提供了分子基础。
蛋白质组驱动的健康监测革新:
血液蛋白质组成为动态健康监测的核心载体。技术创新实现多维度突破:PEA技术灵敏度达fg/mL级,支持5,400+蛋白同步分析;SOMAmer技术突破万级蛋白检测;质谱DIA技术提升临床验证效率。基于此开发的11种衰老模型精准预测阿尔茨海默病、糖尿病等9类年龄相关疾病风险。英国生物银行(UK Biobank)50万人队列研究构建的蛋白质组衰老时钟,显著提升67种疾病的10年风险预测能力(AUC>0.80)。标志性成果包括:9蛋白评分预测心血管事件优于传统模型;GFAP蛋白提前15年预警痴呆;FDA批准OVA1(卵巢癌)、DCP/AFP-L3(肝癌)、CancerSEEK(多癌种)等蛋白标志物用于临床。
定制化治疗的临床转化:
蛋白质组分型推动精准治疗范式升级:肝癌中SOAT1被确证为治疗靶点;卵巢癌微环境代谢酶NNMT驱动化疗耐药;胶质瘤DPYD/TYMP蛋白分型指导耐药机制干预。针对耐药难题,蛋白质组学揭示新策略—抑制脂肪酸氧化酶CPT1A可逆转卵巢癌铂类耐药;调控IRE1α介导的蛋白稳态重编程克服KRAS抑制剂耐药。免疫治疗领域,免疫肽组学加速肿瘤新抗原发现,CAR-T疗法(如神经母细胞瘤)和个体化疫苗(如胶质母细胞瘤)取得突破性进展。
蛋白质组学驱动的 “实践智慧医学”(Phronesis Medicine)前景与挑战:
为应对临床决策复杂性,研究提出Phronesis Medicine(智慧医学)概念,整合分子数据与临床情境实现动态优化。其核心载体TT-HuB国际计划聚焦三大方向:1、单细胞/空间蛋白质组绘制"解剖空间"互作图谱;2、追踪生命周期蛋白质组构建"状态空间"演化模型;3、开发AI驱动的导航系统,实时规划个体化治疗路径。这一范式将推动医疗从静态精准向动态智慧的转型。
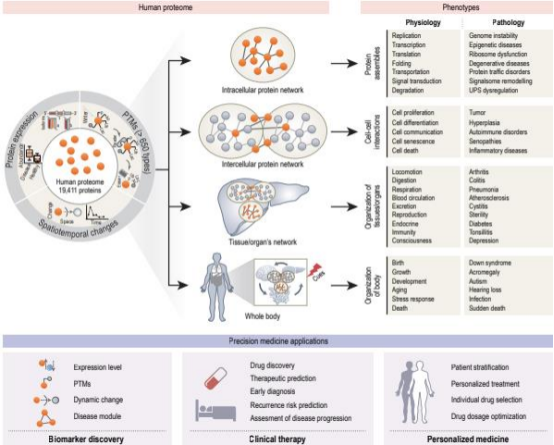
人类蛋白质组到精确医学:从分子特征到个性化健康结果。
总结:
综上所述,蛋白质组学正以前所未有的深度和广度,推动精准医学进入一个崭新的时代。从绘制人类蛋白质组的宏伟蓝图,到实现对个体健康状况的动态监测和疾病风险的精准预测;从揭示疾病的分子异质性、指导个体化治疗,到阐明耐药机制、优化治疗策略,蛋白质组学已成为连接基因蓝图与生命表型的关键桥梁。它不仅弥补了基因组学的局限,更提供了直击疾病本质的分子视角。
展望未来,蛋白质组学的发展潜力巨大。正如文中所述,国际上发起的“人类蛋白组导航项目(π-HuB)”等宏大计划,旨在通过绘制人体蛋白质组的“解剖空间”和“状态空间”,最终构建一个能够指导临床决策的智能导航系统。这一愿景的实现,将依赖于单细胞、空间蛋白质组学等技术的持续创新,以及人工智能在海量数据解析中的深度应用。随着这些前沿技术的成熟和临床转化,我们有理由相信,一个基于个体蛋白质组特征的、真正意义上的个性化医疗时代正加速到来,它将对人类健康和疾病防治产生深远而积极的影响。
